新版本相溶性规范ISO10993-1:2018,尤其是我们所熟识的生物体相溶检测参照明细附则A的总体升级,及其附则B生物体风险管控总体引进ISO TR 15499的升级等,将对医疗设备生产厂家、申请注册人及各检验机构造成结构的危害。
ISO10993-1:2018替代了ISO 10993-1:2009,后者随着无效。新版本规范总共41页,对比上一版的21页,文本內容上面有很大的增长幅度。
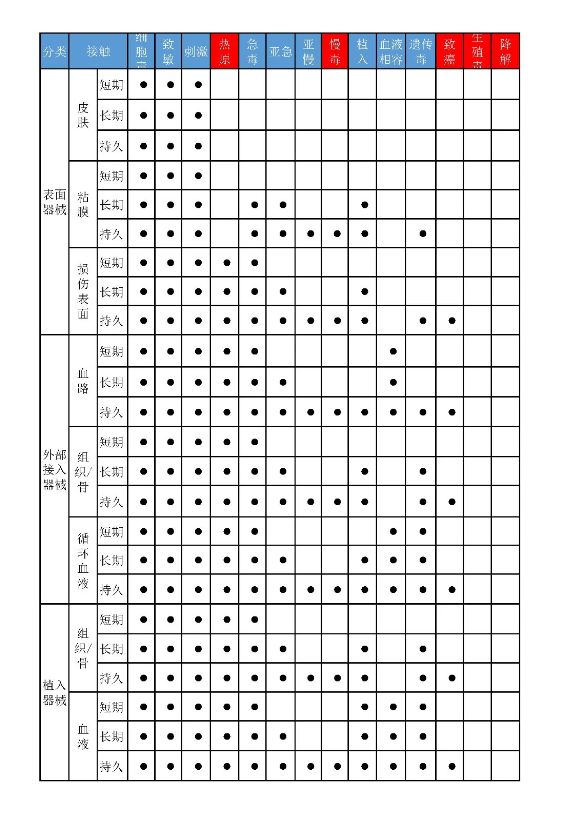
最先,大家根据一个简表来体会下最新版本的相溶性转变:
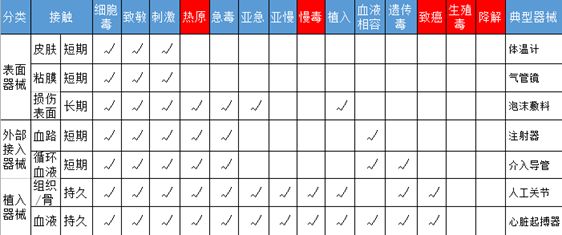
图1 相溶性测试报告简表(一部分)
Note:以上鲜红色为增加测试报告
对于新版本规范提升或变动的一部分,现依据ISO 10993-1:2018的排版设计次序,从规范文章正文即条文4 Generalprinciples为大伙儿前言:
4.1 引进了 physical/chemical information(物理学/化学信息)的新理念,该项商品信息的获得优先选择度排在全部相溶性检测的前边,是新版本分子生物学点评的第一步,并为之后的其他相溶性检测给予了商品信息根据。
新标准 Figure 1 分子生物学风险性管理工作计划中也升级 physical/chemical information,并在流程表第一排中提高了一个新的棱形格 geometry and physical properties(构造和化学性质)。与此同时,流程表中还提升了 clinical use 做为风险管控的点评新项目,可参照图 2 所显示。
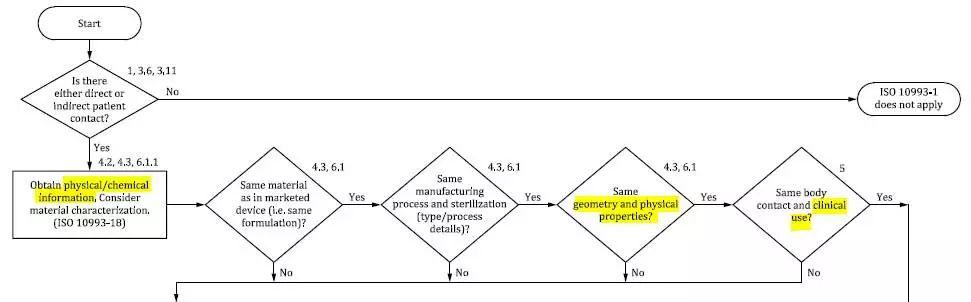
图 2 节选自 ISO 10993-1:2018 Figure 1
4.3 c) packaging materials that directly or indirectly contact the medical device can transfer chemicals to the medical device and then indirectly to the patient or clinician;
分子生物学点评要素新提高了针对包装制品的考虑到。
依据新版本规范,必须考虑到包装制品在货架期内,是不是会造成有毒化合物危害医疗设备的安全系数。例如生物体心脏瓣膜需泡浸储存在代烃饱和溶液中,而盛装饱和溶液的储罐材料通常为橡胶制品,这就必须考虑到在其货架期内,盛装饱和溶液的储罐是不是有化合物总混,从而危害到心脏瓣膜的安全系数。
4.7 The biological safety of a medical device shall be evaluated by the manufacturer over the whole life-cycle of a medical device.
增加条文,生产厂家对医疗设备的生物体安全性评价应遮盖医疗设备项目生命周期。
此条文引进了项目生命周期的分子生物学点评,换句话说分子生物学点评不会再停步于相溶性检测,接着临床研究直到商品暂停上市环节造成的任何数据信息都将变成分子生物学点评汇报升级的必需键入。
4.8 For re-usable medical devices, biological safety shall be evaluated for the maximum number of validated processing cycles by the manufacturer.
增加条文,针对可多次重复使用医疗设备,生产商解决确定过较大解决程度的药物开展生物体安全性评价。
4.11 针对新版本规范基本上规范的一个补充说明:
1) 确立了新版本公布前,已点评完毕的医疗设备不用进行新的相溶性检测;
2)依照新版本规范,一切相溶性检测新项目的免除都必须给予有效表述;
3)历史时间临床医学材料可做为合乎相溶性规定的直接证据以免除检测;
4)一切涉及到相溶性再评估的医疗设备,务必依照新版本规范开展再点评。
5.1 General
确立了气管类医疗设备的归类参考 ISO 18562 系列产品规范。
5.2.1 Non-contacting medical devices
新版本规范遮盖了非触碰类医疗设备,确立了非触碰类医疗设备不用开展相溶性检测,例如医药学确诊APP,血液制品机器设备及其采血管等。
5.2.2 Surface-contacting medical devices
a) Skin
新版本规范提高了 NOTE 表述,确立了选用基本原料的肌肤触碰器材不用太多的分子生物学点评。包含无胶手套触碰器材(如电脑键盘、按键、触摸显示屏、SD 卡、U 盘等)和胶手套触碰器材(如软管的摇杆)。
5.2.3 Externally communicating medical devices
b) Tissue/bone/dentin
Medical devices or components that do not necessarily directly contact tissue or bone but serve as conduits to delivery fluids to the tissue or bone.
用以向机构或骨运输液态的软管类器材,新版本规范区划为外界连接器材。
5.3 Categorization by duration of contact
5.3.1 Contact duration categories
c) Long-term exposure (C) – medical devices whose cumulative sum of single, multiple or repeated contact time exceeds 30 d.
新版本规范中,触碰超出 30 天的医疗设备选用 long-term 更换了 permanent,从描述上更为的认真细致。例如心血管支架为长期性嵌入类医疗设备,但因为受制于电池电量,即使单腔起博器也只有保持 7~8 年,并不可以算是永久性嵌入。
5.3.2 Transitory-contacting medical devices
提升了短暂性触碰医疗设备的界定,要求触碰時间低于 1 分鐘的器材划入为短暂性触碰类,例如柳叶刀杂志、皮内注射针、毛细血管等。 短暂性触碰医疗设备通常不用开展相溶性检测,也未归入附则 A,但该类器材若涉及到积累应用(cumulative use),必须此外点评。
6.1 Physical and chemical information
增加条文,physical and chemical information 为相溶性点评关键的第一步,落实措施可参照 ISO 10993-18,针对纳米复合材料可参照 2017 年新上市的相溶性规范 ISO/TR 10993-22.
6.2 Gap analysis and selection of biological endpoints
增加条文,要求了差别剖析的执行步骤,应参照附则 A 的根基上,融合附则 CLiterature review(参考文献)开展判断。 根据差别剖析的結果,判断存有的不确定性风险性,以决策必须挑选的相溶性检测新项目。
6.3 Biological testing
本次新版本规范增加的测试报告关键参照了 FDA 有关 ISO 10993-1 操作指南 2016版配件 A 的內容,这就代表着相溶性检测的 ISO 规范总体向 FDA 挨近,针对参照 ISO 10993-1 附则 A 的医疗设备生产厂家而言是一个很大的试炼,尤其是例如慢毒、致癌物质等长期性测试报告的添加。
ISO 10993-1 附则 A 升级后,如下图所示:
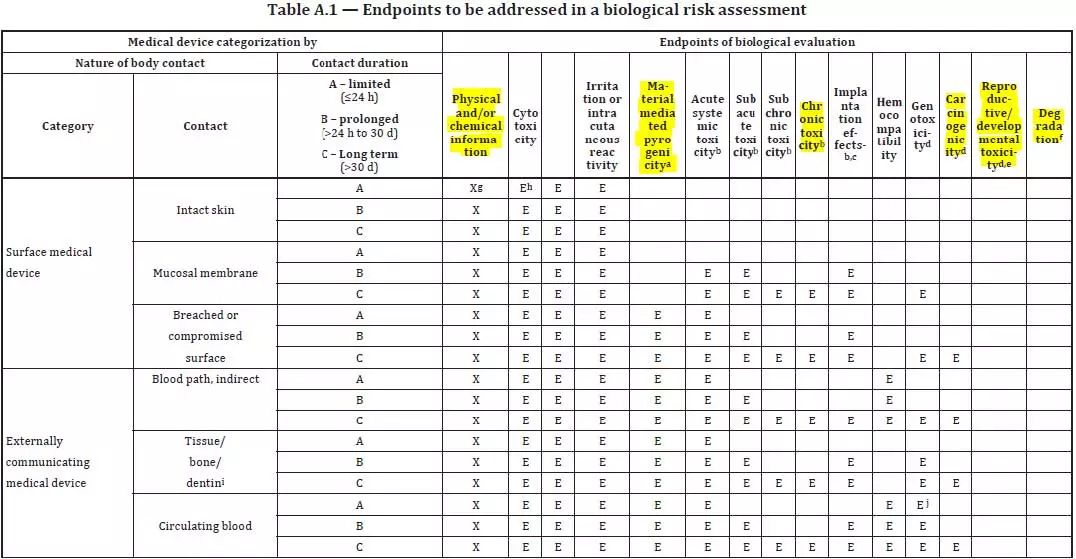 图 3 摘选自 ISO 10993-1:18 附则 A
图 3 摘选自 ISO 10993-1:18 附则 A
1) 应用标记 E 替代上一版的 X 以标志生物体相容性试验终点站;
2) 新版本规范标记 X 表明分子生物学风险评价必须的外置信息内容,如Physical and chemical information;
3) 提升了新的生物体相容性试验新项目(如下图 3 标黄所显示):原材料受体热原、慢毒、致癌物质、生殖系统毒和生物降解。
6.3.2.5 Material-mediated pyrogenicity
附则 A 增加测试报告,原材料受体热原。热原分成类毒素受体热原和原材料受体热原,尽管原材料受体热原在一般医疗设备较为罕见,常见于生物体研究原材料的器材,实验方式多见新西兰兔法。
6.3.2.8 Chronic toxicity
附则 A 增加测试报告,漫性毒副作用。对比亚慢毒副作用,漫性毒副作用的检查周期时间会更长,例如 3 个月的小白鼠亚慢,必须长达 6 个月的小白鼠慢毒。检测期限的延长针对医疗设备迅速发售的节奏感也会是一个很大的试炼,尤其是众多潜在性的合规风险性。
6.3.2.9 Implantation effects
针对嵌入实验,新版本规范拥有重要升级,提议嵌入试验方案可发展为与此同时点评部分反映和全身上下毒副作用,以达到亚急性、亚急、亚慢和慢毒检测的要求。假如很有可能,血夜相溶性点评还可以包括在其中。
6.3.2.11 Carcinogenicity
附则 A 增加测试报告,致癌物质。针对一般医疗设备,致癌物质实验非常少涉及到,但针对触碰時间超出 30 天的医疗设备必须考虑到。新版本规范提议,致癌物质可以合拼漫性毒实验开展,实际可参照 OECD Guideline 453.
6.3.2.12 Reproductive and developmental toxicity
附则 A 增加测试报告,生殖系统毒副作用。针对一般医疗设备,生殖系统毒副作用实验非常少涉及到,但针对预估应用群体为孕妈妈的医疗设备必须考虑到。
6.3.2.13 Degradation
附则 A 增加测试报告,生物降解性。针对生物降解医疗设备,应用身体之外法仿真模拟临床医学应用开展检测,当身体之外检测没法获得充足的数据信息以证实其相溶性时,必须考虑到身体内溶解实验。溶解实验可参照的规范为 ISO 10993-9,ISO 10993-13,ISO 10993-14,ISO 10993-15.
【汇总】
ISO 10993-1:2009 随着着中国医疗器械快速發展的时代,从业微波感应器医疗设备的同行业都并不会生疏,而本次阔别九年的升级重做,也从一个侧边表明了无源医疗设备即将开始更新换代,而监管部门针对相溶性的检测规定一样也已逐渐提升。
【附】 详细的“相溶性测试报告目录”
派旗纳米官网:https://paiqinano.com
大量电子纳米防护涂层剂、配套喷镀设备、OEM代工服务等请关心“派旗纳米”微信公众号
纳米涂层剂理化性能详细参数直接点击:纳米电子防护涂层剂参数
技术咨询:赵先生:130 4896 4893

该文章内容提高散播新技术应用新闻资讯,很有可能有转截/引入之状况,若有侵权行为请联络删掉。
 派旗纳米·官方网站
派旗纳米·官方网站
